美国布里格姆妇女医院心血管疾病预防中心主任 Paul Ridker 博士领导的 CANTOS 研究最新结果显示,IL-1β单克隆抗体 Canakinumab(卡纳单抗,商品名为 Ilaris)可以在标准药物治疗基础上,将心肌梗死后心血管事件的发生风险进一步降低 15%[1]。
该研究首次直接证明抗炎药物可以减少心血管疾病的发病,研究结果于 2017 年 ESC 年会上公布并同步发表于《新英格兰医学杂志》。同时,对 CANTOS 队列的另一项分析发现,最高剂量的 Canakinumab 可将肺癌的发生和死亡风险分别降低 67% 和 77%,而即使是最低剂量的 Canakinumab,也可将肺癌的发生和死亡风险降低 26% 和 33%[2]。
CANTOS 试验研究方法
CANTOS 研究设计为随机、双盲、设安慰剂对照的国际大规模多中心临床试验,共入选来自 39 个国家的 10061 例合并超敏 C 反应蛋白(hs-CRP)升高(>2 mg/L)的心肌梗死患者。患者平均年龄 61 岁,女性占 25.7%,合并糖尿病的比例为 40.0%。大部分患者曾接受血管重建(66.7% 的患者接收 PCI 治疗,14.0% 的患者接收冠脉搭桥治疗)。
所有患者在标准药物治疗基础上,随机分为 4 组:安慰剂组、Canakinumab 50 mg、150 mg 或 300 mg 组,Canakinumab 经皮下注射,3 月/次,中位随访时间 3.7 年。主要终点事件包括非致命性心肌梗死、非致命性中风或由心血管疾病引起的死亡,次要终点事件包括主要终点的任意一个或是需要住院治疗的心绞痛、全因死亡。
CANTOS 试验研究结果
主要终点心血管事件
安慰剂组、Canakinumab 50 mg、150 mg 和 300 mg 组每 100 人-年主要终点心血管事件(非致命性心肌梗死、非致命性中风或由心血管疾病引起的死亡)发生例数分别为 4.5、4.11、3.86 和 3.90。相对于安慰剂组,Canakinumab 治疗组主要终点心血管事件的发生风险分别减少了 7%、15% 和 14%。
次要终点心血管事件
安慰剂组、Canakinumab 50 mg、150 mg 和 300 mg 组每 100 人-年次要终点心血管事件(主要终点的任意一个或是需要住院治疗的心绞痛)发生例数分别为 5.13、4.56、4.29 和 4.25。相对于安慰剂组,Canakinumab 治疗组次要终点心血管事件的发生风险分别减少了 10%、17% 和 17%。
Canakinumab 对 hs-CRP、低密度脂蛋白和高密度脂蛋白的作用
相对于治疗开始前,hs-CRP 水平在 Canakinumab 三个治疗组分别降低了 26%、37% 和 41%,而 LDL、HDL 的水平无明显变化。
CANTOS 研究的意义
炎症假说是近年来提出的参与动脉粥样硬化发生发展的另一机制,大量研究证实炎症细胞和相关信号通路的激活促进粥样斑块的形成,加重斑块不稳定性 [3, 4]。但目前尚无直接证据证实靶向抑制血管炎症反应可以降低心血管事件的发生。Canakinumab 是人 IL-1β的单克隆抗体,CANTOS 研究证实 Canakinumab 可以在降脂药物治疗基础上进一步降低心肌梗死患者不良心血管事件的发生,为动脉粥样硬化的炎症假说提供了直接证据,也为后续更多炎症靶向药物的开发提供了依据。
IL-1 的发现历程
早在 1972 年,Igal Gery 教授就发现了 IL-1 蛋白,但基于其促淋巴细胞分裂的作用,当时被命名为淋巴细胞激活因子 [5, 6]。1977 年 Dinarello 教授纯化出了具有诱导兔子和人类发热作用的蛋白,称为「内源性致热源」[7],1979 年 Dinarello 教授发现该蛋白与淋巴细胞激活因子是同一蛋白。1984 年,研究者发现 IL-1 由两个不同的蛋白组成,即 IL-1α和 IL-1β[8]。随着研究的进展,目前发现 IL-1 家族共有 11 个成员,包括 IL-1α、IL-1β、IL-1 receptor antagonist(IL-1Ra)、IL-18、IL-33 和 IL-1F5~IL-1F10。
IL-1β主要由单核细胞和巨噬细胞合成,静息状态下以蛋白前体形式存在,受到应激可经半胱天冬酶-1(caspase-1)剪切变为活化形式。IL-1β与细胞膜表面的 1 型 IL-1 受体(type 1 IL-1 Receptor,IL-1R1)及白介素受体协同蛋白(IL-1 receptor accessory protein,IL-1RAcP)结合,形成 IL-1R1-IL-1RAcP-IL-1β受体复合物,发挥生物学效应。
Canakinumab 抗体
Canakinumab 由 Novartis 公司生物医药研究院(Novartis Institutes of Biomedical Research,NIBR)在美国波士顿的总部研制成功,是重组人抗人 IL-1β单克隆抗体,与人类 IL-1β特异性结合,阻止其与 IL-1R1 结合从而阻止 IL-1β发挥生物学效应 [9]。Canakinumab 与大鼠、小鼠、兔子及猕猴均不存在交叉反应,但可与狨猴发挥交叉反应,因此 Canakinumab 的药物毒性作用及临床前研究均在狨猴体内完成。
目前获批上市的 IL-1 信号通路的阻断剂还有 Anakinra(特异性 IL-1R1 拮抗剂)和 Rilonacept(可溶性 IL-1 受体,可以与 IL-1α、IL-1β和 IL-1Ra 结合),Canakinumab 与这两种药物不同,是直接针对白细胞介素 1β的抗体类药物,与以上两种药物相比,Canakinumab 半衰期非常长,在 Cryopyrin 蛋白相关周期综合征(CAPS)患者体内 Canakinumab 的平均半衰期可达 26 天。目前阻碍 Canakinumab 推广的唯一缺点就是价格偏高,以 CANTOS 研究为例,一年的治疗费用大约在 6 万美元。
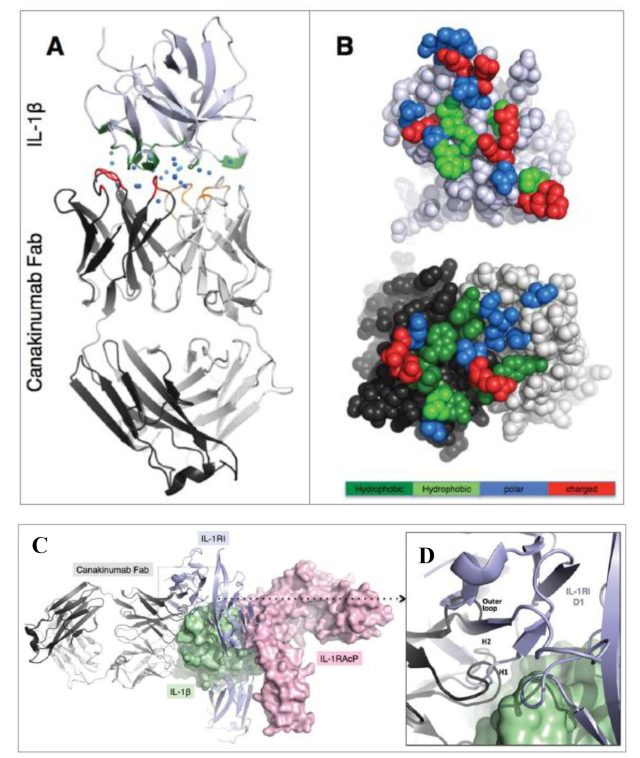
图 Canakinumab 阻断 IL-1β生物学效应的可能机制 [9]
A:Canakinumab 和 IL-1β的结构示意图;B:Canakinumab 的抗体结合位点(下方)和 IL-1β的抗原表位(上方);C: Canakinumab 与 IL-1β形成复合物,从而竞争性抑制 IL-1R1-IL-1RAcP-IL-1β复合物的形成,抑制 IL-1β下游信号通路的激活;D:Canakinumab 的 H1、H2 结构域及外侧环路区域与 IL-1R1 的 D1 结构域形成空间位阻,从而抑制 IL-1β与 IL-1R1 的结合。
IL-1β与心肌梗死后心律失常
研究显示 IL-1β通过募集炎症细胞、调节炎症因子的表达和细胞外基质成分参与心肌梗死后心肌重构。但目前 IL-1β在心肌梗死后心律失常发生中的作用尚不清楚。De Jesus NM 等人在炎症小鼠模型中的研究证实,使用 IL-1R1 拮抗剂 Anakinra 可以显著改善心脏传导功能,改善细胞内 Ca2+浓度,降低跨膜电位和 Ca2+交替幅度,降低自发和诱发的室性心律失常发生率。Anakinra 发挥抗心梗后心律失常的机制可能与增加缝隙连接蛋白 43 和肌浆网 Ca2+-ATPase 表达水平有关 [10]。
众所周知,心脏自主神经失平衡(交感神经过度激活和迷走神经活性降低)在心肌梗死后心律失常的发生中发挥重要作用。我们近期的研究提示 [11],左侧星状神经节局部注射 IL-1β可加重心脏自主神经失平衡程度,从而降低心室动作电位时程和有效不应期、增加回复曲线最大斜率,加重缺血后心律失常的发生。IL-1β加重心脏自主神经失平衡的机制可能与 IL-1β调节神经生长因子、神经肽 Y 和神经元型一氧化氮合成酶的表达有关。重组 IL-1Ra 预处理可明显抑制 IL-1β的促缺血性心律失常作用。
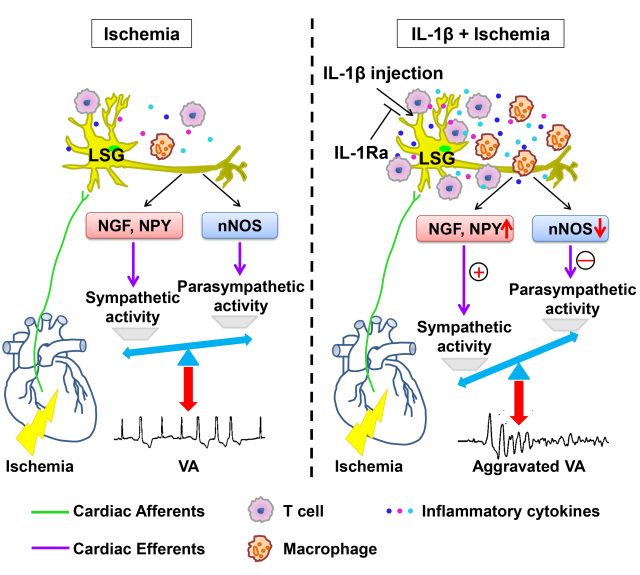
图 IL-1β通过调节心脏自主神经活性发挥促心律失常作用
小结
炎症反应在多种心血管疾病的发生发展中发挥重要作用,CANTOS 研究进一步推进了冠状动脉疾病的炎症假说。尚需更多的研究明确 Canakinumab 在心肌梗死患者中的适用人群,而如何降低 Canakinumab 的治疗费用对其临床推广具有重要影响。此外,寻找更多的抗炎治疗靶点及药物对心血管疾病的治疗具有重要意义。
参考文献
[1] Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease[J]. N Engl J Med, 2017. doi: 10.1056/NEJMoa1707914.
[2] Ridker PM, MacFadyen JG, Thuren T, et al. Effect of interleukin-1β inhibition with canakinumab on incident lung cancer in patients with atherosclerosis: exploratory results from a randomised, double-blind, placebo-controlled trial[J]. The Lancet, 2017. https://doi.org/10.1016/S0140-6736(17)32247-X
[3] Hansson GK. Inflammation, atherosclerosis, and coronary artery disease[J]. N Engl J Med, 2005,352(16):1685-1695.
[4] Libby P, Ridker PM, Hansson GK. Inflammation in atherosclerosis: from pathophysiology to practice[J]. J Am Coll Cardiol, 2009,54(23):2129-2138.
[5] Gery I, Gershon RK, Waksman BH. Potentiation of the T-lymphocyte response to mitogens. I. The responding cell[J]. J Exp Med, 1972,136(1):128-142.
[6] Gery I, Waksman BH. Potentiation of the T-lymphocyte response to mitogens. II. The cellular source of potentiating mediator(s)[J]. J Exp Med, 1972,136(1):143-155.
[7] Dinarello CA, Renfer L, Wolff SM. Human leukocytic pyrogen: purification and development of a radioimmunoassay[J]. Proc Natl Acad Sci U S A, 1977,74(10):4624-4627.
[8] March CJ, Mosley B, Larsen A, et al. Cloning, sequence and expression of two distinct human interleukin-1 complementary DNAs[J]. Nature, 1985,315(6021):641-647.
[9] Rondeau JM, Ramage P, Zurini M, et al. The molecular mode of action and species specificity of canakinumab, a human monoclonal antibody neutralizing IL-1beta[J]. MAbs, 2015,7(6):1151-1160.
[10] De Jesus NM, Wang L, Lai J, et al. Antiarrhythmic effects of interleukin 1 inhibition after myocardial infarction[J]. Heart Rhythm, 2017,14(5):727-736.
[11] Wang M, Li S, Zhou X, et al. Increased inflammation promotes ventricular arrhythmia through aggravating left stellate ganglion remodeling in a canine ischemia model[J]. Int J Cardiol, 2017. doi: 10.1016/j.ijcard.2017.08.011.
