真菌细胞结构

图 1:真菌细胞结构
真菌属于真核细胞,有核孔复合物,胞浆中有细胞骨架微丝及各种细胞器
1. 细胞壁
细胞壁主要物质为碳水化合物,包括一些晶状物质,如α-葡聚糖、几丁质、β-(1,3) 葡聚糖联合的 N-乙酰糖胺聚合物。其它如甘露聚糖等。
(几丁质:真菌荧光染色的主要成分;甘露聚糖-GM 实验主要用于曲霉的血清学检测)
2. 细胞膜
包括磷脂、麦角固醇、葡聚糖合成酶等
主要系统性抗真菌药物
1. 麦角固醇的合成
唑类和多烯类抗真菌药物通过影响麦角固醇起到抗真菌作用。(麦角固醇的合成见图 2)
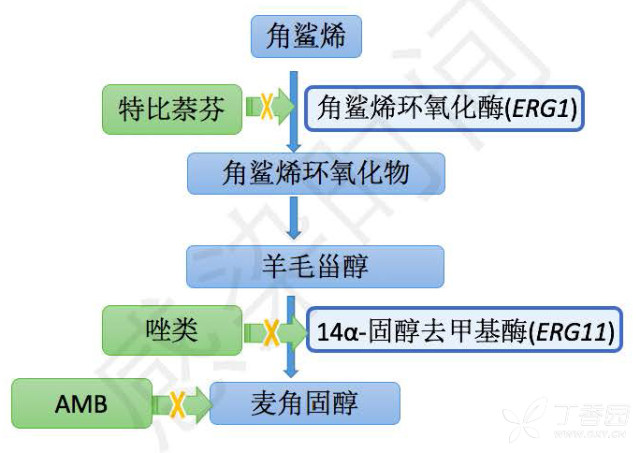
图 2:麦角固醇的合成及抗真菌药物作用
2. 唑类作用机制
麦角固醇是很多真菌的细胞膜甾醇的主要成分。通过抑制 14α-固醇去甲基酶(羊毛甾醇去甲基酶),这是一种真菌细胞色素 P450(cytochrome P450, CYP)依赖酶,唑类药物使细胞膜的麦角固醇不能正常合成,损伤真菌细胞膜,导致真菌死亡。
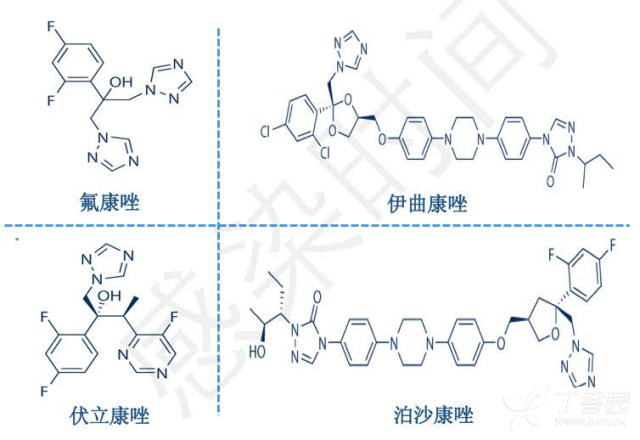
图 3 唑类药物化学式
14α-去甲基酶位点与唑类药物的结构主要影响了药物与靶酶的亲和性,对一些真菌种类,唑类可产生交叉耐药。伊曲康唑和泊沙康唑延长的非极性侧链加强了与 14α-去甲基酶的结合,所以抗菌谱也更宽。伏立康唑是氟康唑的衍生物,但其结构上有一个α-0-methyl group,所以可以抗曲霉和其他丝状真菌。
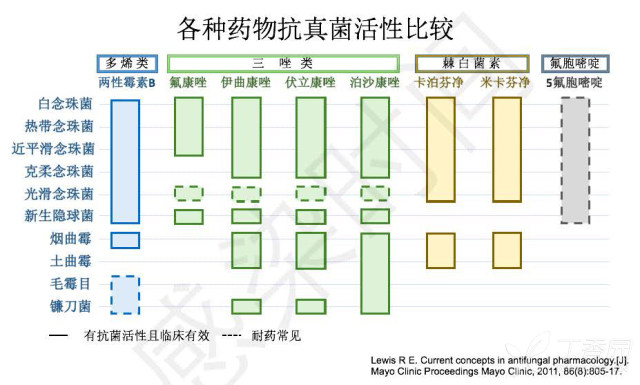
三唑类药物耐药主要由于 14α-去甲基酶上与唑类结合位点的改变(azole binding pocket of 14α-demethylase),氟康唑耐药与 MDR1 外排泵的过表达外有关,外排泵 CDR1 及 CDR2 可使唑类交叉耐药。克柔念珠菌对氟康唑的天然耐药与药物和 14α-去甲基酶的结合受损有关,而新的唑类加强了这种结合。光滑念珠菌对氟康唑耐药通常是外排泵过表达的结果,因此,经常产生唑类的交叉耐药。
3. 特比萘芬作用机制:
与唑类相似,特比萘芬抑制角鲨烯环氧化酶来抑制麦角固醇的合成,特比萘芬主要分布在皮肤和甲床中,而血药浓度相对较低,一般用于甲癣和皮肤真菌病。
4. 两性霉素 B 作用机制:
AMB 直接和麦角固醇结合形成复合体,并形成孔道,导致细胞内物质外泄。两性霉素 B 对麦角固醇丰富的细胞膜以及胆固醇丰富的细胞膜(哺乳动物及人)均有影响,所以可造成毒副作用,比如在肾脏富集,造成肾损伤。两性霉素 B 也可以使促炎细胞因子释放,导致输注过程的发热,寒颤。两性霉素 B 含脂复合制剂可减少肾脏分布,毒副作用减轻。AMB 临床耐药罕见,固醇类的替代以及产生中和酶来耐受氧损伤是 AMB 天然耐药及获得性耐药的主要机制。
5. 棘白菌素作用机制:
棘白菌素作用于真菌细胞壁,通过抑制β-(1,3)-d-葡聚糖合成酶来抑制细胞壁主要结构之一的β-(1,3)-d-葡聚糖的合成发挥作用。细胞壁中β-1,3-d-葡聚糖合成过程及酶的表达主要决定了棘白菌素的抗真菌谱。棘白菌素对念珠菌属及曲霉菌属有较好活性。耐药罕见,「热点」地带 FKS1 及 FKS2 突变导致的β-(1,3)-d-葡聚糖合成酶的主要催化亚基改变可导致棘白菌素作用降低,MICs 升高以及治疗失败。
6. 氟胞嘧啶:
氟胞嘧啶经胞嘧啶透酶进入真菌细胞,经胞嘧啶脱氨酶代谢为氟尿嘧啶,代替尿嘧啶导致真菌 RNA 的错误编码。然而,肠道菌群也可以把 5-氟胞嘧啶转变为 5-氟尿嘧啶,导致恶心、呕吐、腹泻以及骨髓抑制等不良反应。而胞嘧啶透酶、胞嘧啶脱氨酶突变容易发生,所以氟胞嘧啶一般仅用于联合治疗。
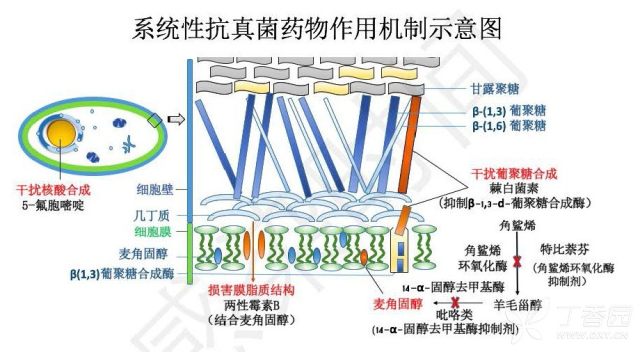
图 4. 系统性抗真菌药物作用机制示意图
药物的抗真菌活性比较
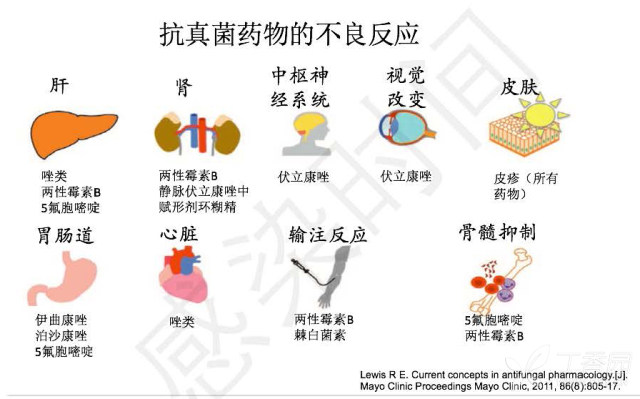
抗真菌药物的不良反应
参考书籍:
1.《MCM11th》
2.《实用抗感染治疗学》
3.《医学真菌学-实验室检验指南》
参考文献:
1. Lewis R E. Current concepts in antifungal pharmacology.[J]. Mayo Clinic Proceedings Mayo Clinic, 2011, 86(8):805-17.
2. Xie J L, Polvi E J, Shekharguturja T, et al. Elucidating drug resistance in human fungal pathogens.[J]. Future Microbiology, 2014, 9(4):523.
3. Denning D W, Bromley M J. How to bolster the antifungal pipeline[J]. Science, 2015, 347(6229):1414-1416.
4. Lupetti A, Danesi R, Campa M, et al. Molecular basis of resistance to azole antifungals.[J]. Trends in Molecular Medicine, 2002, 8(2):76-81.
