JACC:CARDIOVASCULAR IMAGING 最近报道了一篇文献,对已接受过 TAVR 治疗患者的人工瓣膜进行组织学研究,取出生物瓣的方式为尸体解剖或手术。
研究对取得的瓣膜标本进行病理切片处理,其中 HE 染色、Movat 染色及 Von Kossa 染色分别用于评估切片整体病理分析、纤维化及钙化程度。免疫组化染色用来评估细胞表面蛋白表达,其中 CD31 作为内皮细胞标志物,CD45 作为炎症细胞浸润标记,MMP-1 则提示细胞外基质的聚集及重塑。另外光子共聚焦显微镜及电镜分别用于分析切片内胶原蛋白、弹力蛋白成分以及钙化。
研究最终纳入来源于 22 个患者的 23 个瓣膜样本,其中 20 个是由尸体解剖所得。患者平均年龄为 81.17 岁,有 2 位患者为二叶式主动脉瓣。样本的具体情况如表 1 所示。
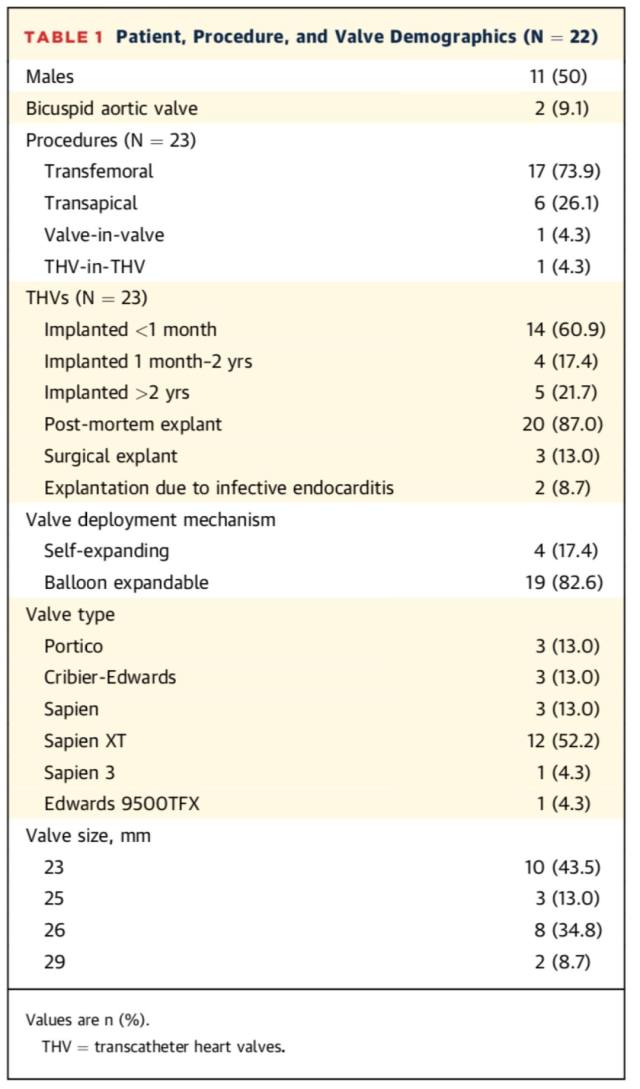
1. 瓣叶厚度
研究发现植入体内超过 2 年的生物瓣,其最大瓣叶厚度大于植入时间低于 2 年的瓣膜(图 1A 及 1B)。另外,瓣叶厚度随时间的增加而增加(图 1C)。
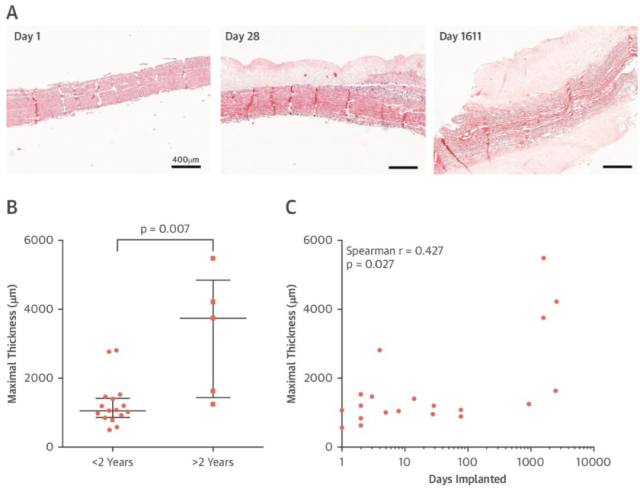
图 1 A:不同时间瓣膜切片的 HE 染色;B:植入时间大于 2 年与小于 2 年瓣膜的厚度比较;C:瓣叶厚度随植入时间的改变
2. 血栓形成
血栓几乎在释放后立即形成(植入时间 0 天,Sapien 3 瓣膜,由手术方式取出)。尽管取出的生物瓣可能受到急性并发症的影响,但是血栓几乎出现在所有研究的瓣膜中,早至术后 1 天,晚至术后 2583 天。血栓在主动脉及心室均有发现,其形状既有层状,也有乳头状,提示血栓可能在层流或湍流的模式下形成(图 2E)。在植入时间小于 30 天的亚组分析中发现 50% 的样本出现瓣叶血栓,且以瓣叶基底部为主(图 2F)。
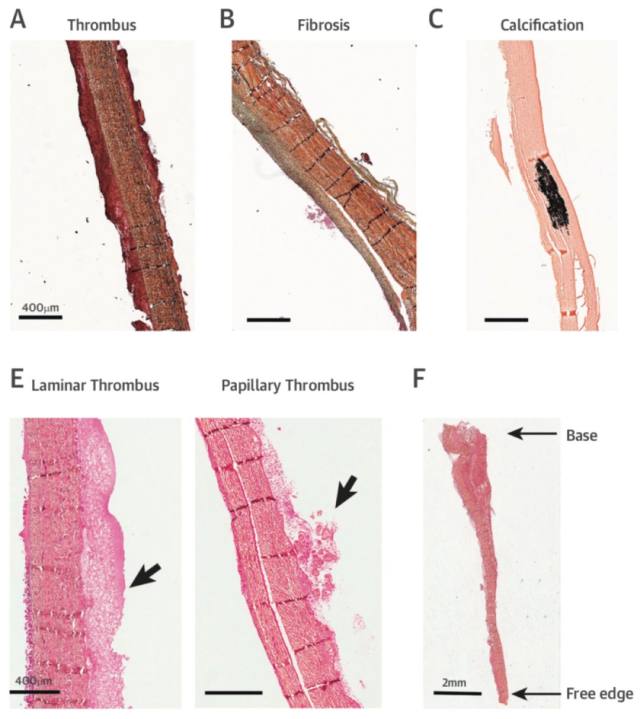
图 2 A、B、C:分别表示血栓,纤维化及钙化形成;E:血栓的层状及乳头状形态;F:早期血栓形成(60 天以内)多在瓣叶基底部
3. 瓣膜内皮及炎症
基于早期血栓形成的观察,可以假设血栓形成在瓣膜内皮化之前。然而,CD31+的类内皮细胞在几乎所有瓣膜标本中表达(包括那些植入时间只有 1 天的瓣膜),同时形成的血栓覆盖在内皮细胞之上。CD31+的类内皮细胞呈现出异常的假复层柱状细胞排列(图 3A、3B),半定量分析表明此种排列最常出现于植入时间为 8-30 天的瓣膜上。另外多核巨细胞、CD45+细胞的发现均提示有炎症细胞的浸润(图 3D、3E)。
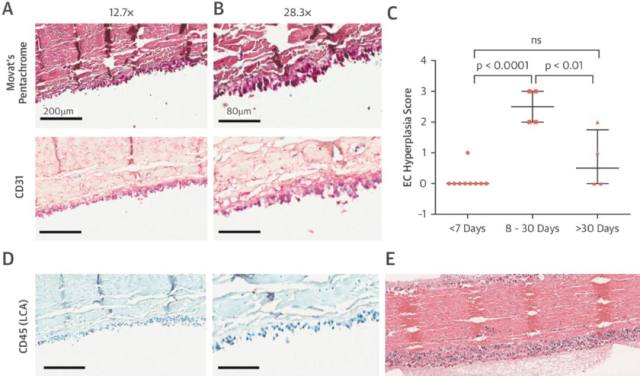
图 3 A、B:CD31 的半定量分析证明植入时间 1 月较 1 周的生物瓣期内皮细胞的增生明显增加;C、D:CD45/LCA 表达证明炎症细胞浸润,E 表明 HE 染色切片上可见巨大细胞,多核巨细胞及中性粒细胞浸润
4. 纤维化
血栓合并纤维化的形成在植入时间超过 60 天的生物瓣中均有发现,纤维化同时还出现在主动脉及心室表面(图 2B)。瓣叶纤维化的过程提示有再重塑及再机化的机制,因组织染色提示有非成熟-成熟纤维组织的形成过程。亚组分析表明在植入后 946,1611 天及 2496 天,同一切片可出现不同程度的纤维化,其中不成熟纤维组织中的核心蛋白聚糖较成熟纤维组偏少,而 MMP-1 作为可调控胶原重塑的蛋白在纤维组织的部位也有表达(图 4)。
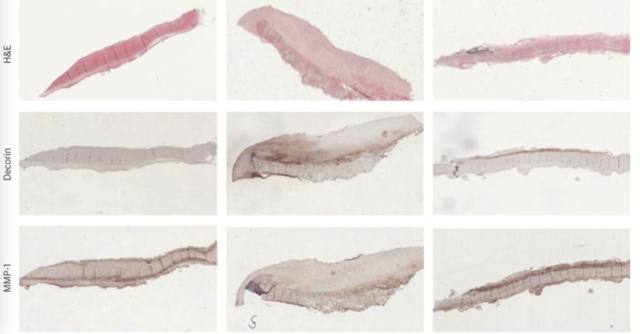
图 4:纤维化瓣膜的亚组分析,在植入后 946,1611,2496 天
5. 钙化
在 4 例植入时间超过 4 年的生物瓣中,钙化、血栓及纤维化均有形成(图 2C)。由于瓣中瓣或感染性心内膜炎可能对钙化造成影响,故排除这两部分患者后发现钙化最早在植入时间为 145 天的患者出现。在 5 例出现钙化的生物瓣中,钙化部位同时伴有粘附血栓及纤维组织,其发生的部位局限在瓣叶,并因此破坏了瓣膜结构(图 5B 为电镜图)。

图 5 A:瓣膜钙化、血栓及纤维组织出现在生物瓣瓣叶;B:电镜下观察到的钙化组织
总结
本研究从组织学的角度观察经导管人工瓣膜植入体内后的表现,发现经导管生物瓣植入体内后有血栓形成、增厚、纤维化和钙化等改变,为今后人工瓣膜耐久性的研究和抗栓的治疗策略奠定了一定的基础。
参考文献
Transcatheter Aortic Heart Valves:Histological Analysis Providing Insight to Leaflet Thickening and Structural Valve Degeneration. J Am Coll Cardiol Img 2018.
文章转载自微信公众号: 浙二医院心脏瓣膜团队
图片来源:浙二医院心脏瓣膜团队(题图有剪裁)
